БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 6. ОБМІН І ФУНКЦІЇ АМІНОКИСЛОТ. БІОСИНТЕЗ БІЛКА
6.8. Обмін окремих амінокислот
6.8.2.Обмін метіоніну та цистеїну
До складу білків людини входять дві сірковмісні амінокислоти - метіонін і цистеїн. Вони метаболічно тісно пов'язані між собою.
Метіонін - незамінна амінокислота. Вона необхідна для синтезу білків організму, бере участь у реакціях дезамінування, є джерелом атома сірки для синтезу цистеїну. Метіоніл-тРНК бере участь в ініціації процесу трансляції.
Метильна група метіоніну - мобільний одновуглецевий фрагмент, що використовується для синтезу ряду сполук. Перенесення цієї групи на відповідний акцептор називають реакцією транс - метилювання. Вона має важливе метаболічне значення.
Метильна група в молекулі метіоніну міцно зв'язана з атомом сірки, тому безпосереднім донором цього одновуглецевого фрагмента слугує активна форма амінокислоти.
Активною формою метіоніну є S-аденозилметіонін (SAM) - сульфонієва форма амінокислоти, яка утворюється в результаті приєднання метіоніну до молекули аденозину, а він утворюється під час гідролізу АТФ:
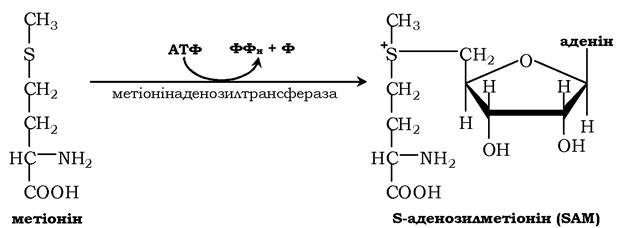
Цю реакцію каталізує присутній у всіх типах клітин фермент метіонінаденозилтрансфераза. Структура (-S+ -СН3) у SAM - нестабільне угруповання, що визначає високу активність метильної групи (звідси термін "активний метіонін»). Ця реакція є унікальною для біологічних систем, тому що вона, найпевніше, є єдиною відомою реакцією, унаслідок якої вивільнюються усі три фосфатні залишки АТФ.
Відщеплення метильної групи від SAM і перенесення її на сполуку-акцептор каталізують ферменти метилтрансферази. SAM у результаті реакції перетворюється на S-аденозилгомоцистеїн (SAT).
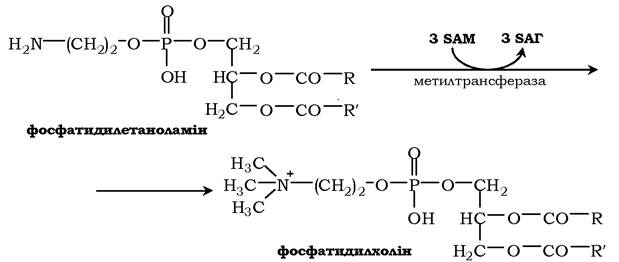
Синтез фосфатидилхоліну з фосфатидилетаноламіну. Фосфатидилхоліни (лецитини) - найпоширеніша група гліцерофосфоліпідів, що беруть участь в утворенні мембран клітин і ліпопротеїнів, у складі яких здійснюється транспорт ліпідів:
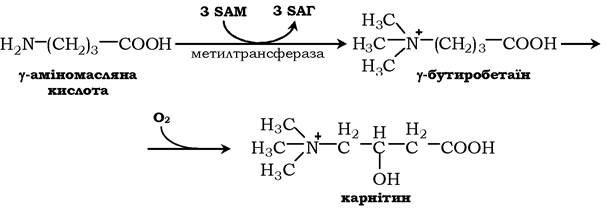
Карнітин - переносник жирних кислот через мембрану мітохондрій.
Креатин необхідний для утворення у м'язах високоенергетичної сполуки - креатинфосфату. Синтез креатину відбувається у дві стадії за участю трьох амінокислот: аргініну, гліцину та метіоніну. У нирках утворюється гуанідинацетат під дією гліцинамідинтрансферази:
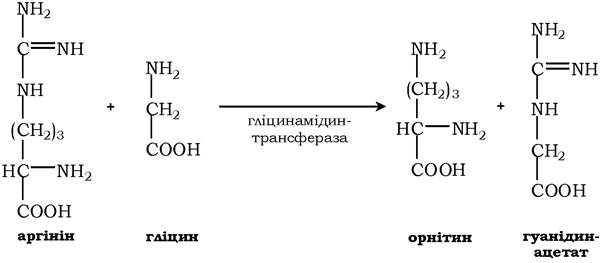
Потім гуанідинацетат транспортується в печінку, де відбувається реакція його метилювання:
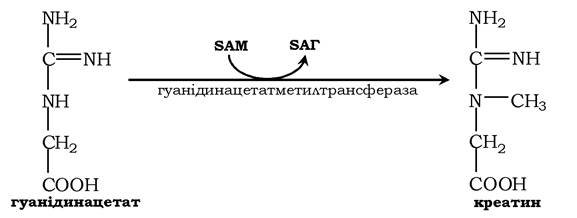
Креатин із кровотоком переноситься у м'язи та клітини мозку, де з нього утворюється високоенергетична сполука - креатинфосфат:
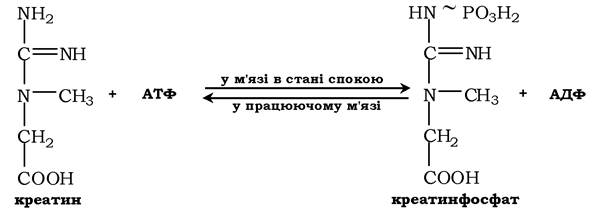
Реакція легко змінює напрямок і каталізується ферментом креатинкіназою, локалізованою в цитозолі й мітохондріях клітин і є органоспецифічною. У нормі активність ферменту в крові дуже мала. Знайдено три ізоферментні форми креатинкінази (див. розд. 7).
Креатинфосфат відіграє важливу роль у забезпеченні працюючого м'яза в початковий період. У результаті неферментативного дефосфорилювання, головним чином у м'язах, креатинфосфат перетворюється в креатинін і виводиться із сечею. Добове виділення креатиніну в кожного індивідуума постійне та пропорційне загальній масі м'язів:
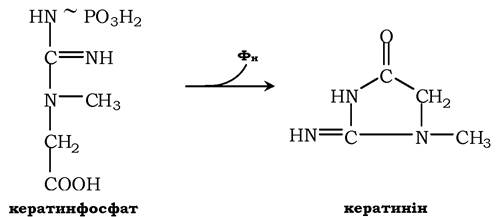
Визначення вмісту креатину та креатиніну в крові та в сечі використовується для характеристики інтенсивності роботи м'язів у спортивній медицині й при деяких патологічних станах. Визначення активності ферменту креатинкінази та його ізофер- ментних форм у крові використовується в медицині для діагностики таких захворювань, як інфаркт міокарда, міопатії, м'язові дистрофії тощо.
Реакції трансметилювання використовуються також для:
✵ синтезу адреналіну з норадреналіну;
✵ синтезу анзерину з карнозину;
✵ метилювання азотистих основ у нуклеотидах та ін.;
✵ інактивації метаболітів (гормонів, медіаторів тощо) і знешкодження чужорідних сполук, включаючи й лікарські препарати.
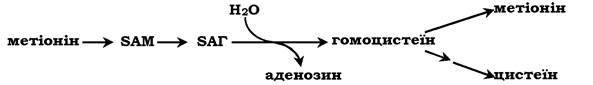
Реакції метилювання відіграють важливу роль в організмі й проходять дуже інтенсивно, що викликає велику витрату метіоніну, оскільки він є незамінною амінокислотою (у клітинах метіонін синтезуватися не може). У зв'язку з цим великого значення набуває можливість регенерації метіоніну за участю замінних амінокислот (Сер, Глі). У результаті відщеплення метильної групи SAM перетворюється в S-аденозилгомоцистеїн (SAT), який під дією гідролази розщеплюється на аденозин і гомоцистеїн:
![]()
Гомоцистеїн може знову перетворюватися в метіонін під дією гомоцистеїнметилтрансферази. Донором метильної групи в цьому випадку слугує N5-метил-H4-фолат:
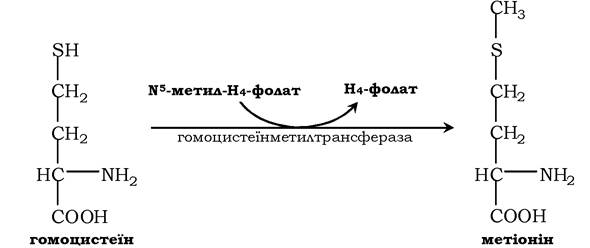
Проміжним переносником метильної групи в цій реакції є похідне вітаміну В12 - метилкобаламін, що виконує роль коферменту.
Метіонін - незамінна амінокислота, однак вона може регенеруватися з гомоцистеїну. Отже, незамінним є саме гомоцистеїн, але єдиним його джерелом в організмі є метіонін. В їжі гомоцистеїну дуже мало, тому потреби людини в метіоніні та гомоцистеїні забезпечуються тільки метіоніном, що надходить з їжею.
Загальну схему метаболізму метіоніну, пов'язану з обміном одновуглецевих фрагментів, наведено на рис. 6.27.
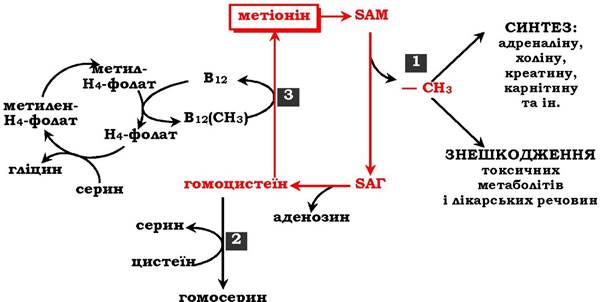
Рис. 6.27. Метаболізм метіоніну:
1 - реакції трансамінування; 2 - синтез цистеїну; 3 - регенерація метіоніну
Первинним донором одновуглецевих фрагментів є серин. Утворений N5,N10-метилен-H4-фолат відновлюється до N5-метил-H4-фолату, що передає метильну групу на кобаламін (В12). Метилкобаламін безпосередньо бере участь у регенерації метіоніну. Гомоцистеїн може використовуватись також для синтезу цистеїну.
Друга сірковмісна амінокислота - цистеїн. Він є умовнозамінним, оскільки для його синтезу необхідний атом сірки, джерелом якого слугує незамінна амінокислота метіонін.
Для синтезу цистеїну необхідні дві амінокислоти:
✵ серин - донор вуглецевого скелету;
✵ метіонін - первинне джерело атома S.
Синтез цистеїну з гомоцистеїну відбувається у дві стадії під дією піридоксальзалежних ферментів цистатіонінсинтази та цистатіонінліази:
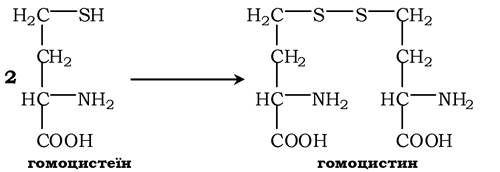
При порушенні використання гомоцистеїну в організмі з нього утворюється гомоцистин:
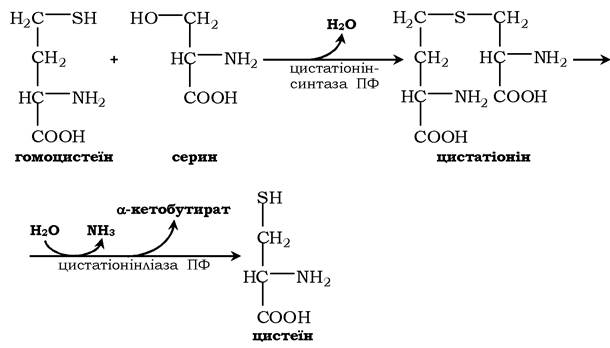
Гомоцистин може накопичуватись у крові та тканинах, виділятись із сечею, викликаючи гомоцистинурію. Можливою причиною є спадкові порушення обміну гомоцистеїну або гіповітаміноз фолієвої кислоти, а також вітамінів В12 і В6. З інших біохімічних порушень можна відмітити цистатіонінурію, що також часто виникає у разі недостатності вітамінів групи В.
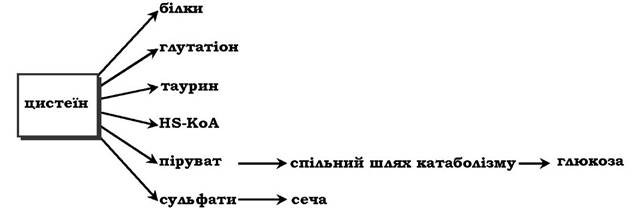
Біологічні функції цистеїну різноманітні й дуже важливі для організму. Так, цистеїн, що входить до складу білків, відіграє надзвичайно важливу роль у їхньому фолдингу, оскільки тіогрупи цистеїну здатні утворювати міцний дисульфідний зв'язок. При цьому два залишки цистеїну формують молекулу цистину:
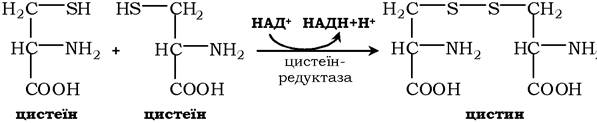
Окисна реакція відбувається або за участю коферменту НАД+ під дією ферменту цистеїнредуктази, або неферментативно. Дисульфідні зв'язки стабілізують просторову структуру поліпептидного ланцюга або зв'язують між собою два ланцюга (наприклад, А- і В-ланцюги гормону інсуліну). Велика кількість білків і ферментів в активному центрі містять SH-групи, які беруть участь у каталізі. Унаслідок їхнього окиснення ферментативна активність знижується. Відновлення SH-груп часто відбувається з використанням глутатіону - атипового трипептиду, що містить γ-глутамінову кислоту, цистеїн і гліцин:
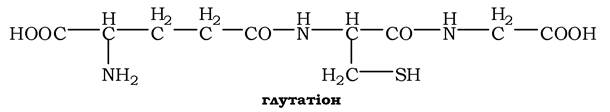
Глутатіон може існувати у двох формах - відновленій (Г-SH) і окисненій (Г-S-S-Г) і є активним антиоксидантом в організмі людини.
Ще одним важливим шляхом використання цистеїну можна вважати синтез таурину у тваринних тканинах, який відбувається шляхом декарбоксилювання похідних цистеїну - цистеїнової та цистеїнсульфінової кислот:
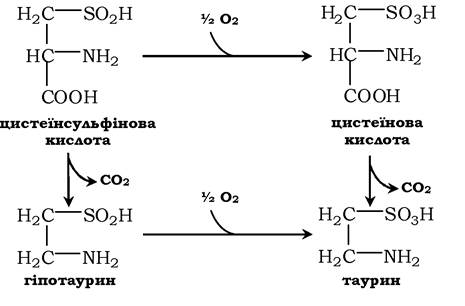
Таурин необхідний для синтезу парних жовчних кислот у печінці. Крім того, він важливий для клітини як антиоксидант і застосовується для зниження ПОЛ і зв'язування гіпохлоританіону (у формі хлорамінового комплексу).
Цистеїн також слугує попередником тіоетаноламінового фрагмента HS-КоА (коферменту А).
Катаболізм цистеїну відбувається окисним шляхом:
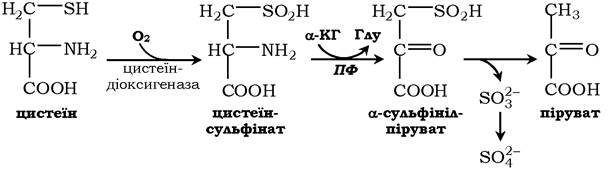
Сульфіт, який утворюється внаслідок реакції, перетворюється в сульфат і виводиться із сечею або перетворюється в ефірно- сірчані кислоти, які також екскретуються нирками. Цистеїн - практично єдине джерело сульфітів сечі, шляхи його використання зображено на схемі: