Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Биологическое окисление
Ферменты и коферменты, участвующие в окислительно-восстановительных процессах
Ферменты, катализирующие окислительновосстановительные реакции, называют оксидоредуктазами. Их разделяют на 5 групп.
1) Оксидазы. Истинные оксидазы катализируют удаление водорода из субстрата, используя при этом в качестве акцептора водорода только кислород1. Они неизменно содержат медь, продуктом реакции является вода (исключение составляют реакции, катализируемые уриказой и моноаминоксидазой, в результате которых образуется Н2О2) (рис. 12.1).
2) Аэробные дегидрогеназы — ферменты, катализирующие удаление водорода из субстрата; в отличие от оксидаз они могут использовать в качестве акцептора водорода не только кислород, но и искусственные акцепторы, такие, как метиленовый синий. Эти дегидрогеназы относятся к флавопротеинам, и продуктом катализируемой ими реакции является перекись водорода, а не вода (рис. 12.2).
3) Анаэробные дегидрогеназы — ферменты, катализирующие удаление водорода из субстрата, но не способные использовать кислород в качестве акцептора водорода. В этот класс входит большое число ферментов. Они выполняют две главные функции.
а. Перенос водорода с одного субстрата на другой в сопряженной окислительно-восстановительной реакции (рис. 12.3). Эти дегидрогеназы специфичны к субстратам, но часто используют один и тот же кофермент или переносчик водорода. Поскольку рассматриваемые реакции обратимы, они обеспечивают в клетке свободный перенос восстановительных эквивалентов. Реакции этого типа, приводящие к окислению одного субстрата за счет восстановления другого, особенно важны для осуществления окислительных процессов в отсутствие кислорода.
4) Гидрокснпероксидазы — ферменты, использующие в качестве субстрата перекись водорода или органические перекиси. К этой категории относятся два типа ферментов: пероксидазы, находящиеся в составе молока, в растениях, лейкоцитах, тромбоцитах, эритроцитах и т.д., и каталаза, функционирующая в тканях животных и растений.
5) Оксигеназы — ферменты, катализирующие прямое введение кислорода в молекулу субстрата.
1 Иногда «оксидазами» называют все ферменты, катализирующие реакции, идущие с участием молекулярного кислорода.

Рис. 12.1. Окисление метаболита, катализируемое оксидазой.

Рис. 12.2. Окисление метаболита, катализируемое аэробной дегидрогеназой.

Рис. 12.3. Окисление метаболита, катализируемое анаэробными дегидрогеназами (без участия дыхательной цепи).
б. Функцию компонентов дыхательной цепи, обеспечивающих транспорт электронов от субстрата на кислород (рис. 12.4).

Рис. 12.4. Окисление метаболита анаэробными дегидрогеназами и — на завершающей стадии — истинной оксидазой дыхательной цепи.
Оксидазы
Цитохромоксидаза — гемопротеин, широко распространенный в растительных и животных тканях. Она служит конечным компонентом цепи дыхательных переносчиков, локализованных в митохондриях, и катализирует реакцию, в результате которой электроны, высвобождающиеся из молекул субстрата при их окислении дегидрогеназами, переносятся на конечный акцептор — кислород. Данный фермент отравляется окисью углерода, цианидом и сероводородом. Иногда цитохромоксидазу называют цитохромом с3. Первоначально предполагали, что цитохром а и цитохром а3 — это автономные гемопротеины, поскольку каждый из них характеризуется определенным спектром, кроме того, они проявляют разную чувствительность к действию окиси углерода и цианида. В дальнейшем же было показано, что эти два цитохрома входят в состав комплекса, который получил название цитохром аа3. Он содержит две молекулы гема, в каждой из которых атом железа может переходить из состояния Fe2+ в состояние Fe3+ и обратно в ходе окисления и восстановления, а также два атома Сu, каждый из которых взаимодействует с одним из гемов.
Фенолаза (тирозиназа, полифенолоксидаза, катехолоксидаза) — это медьсодержащий фермент с широкой специфичностью. Он катализирует превращение монофенола (в присутствии о-дифенола) в о-хинон. Медь обнаружена в ряде других ферментов, в частности в урнказе, катализирующей окисление мочевой кислоты в аллантоин, и в моноамниоксидазе, окисляющей адреналин и тирамин в митохондриях.
Аэробные дегидрогеназы
Аэробные дегидрогеназы являются флавопротеинами; они содержат в качестве простетической группы флавинмононуклеотид (FMN) или флавинадениндинуклеотид (FAD). FMN и FAD образуются в организме человека из витамина рибофлавина (рис. 12.5).
Рибофлавин (витамин В2) в тканях млекопитающих не синтезируется; он образуется в растениях и микроорганизмах и является, следовательно, незаменимым компонентом диеты. В состав молекулы рибофлавина входят сахарный спирт рибитол и гетероциклический флавин. В тканях рибофлавин путем ATP-зависимого фосфорилирования превращается в FMN (рис. 12.6); далее путем переноса АМР от другой молекулы АТР образуется FAD (рис. 12.7).

Рис. 12.5. Рибофлавин.
FMN и FAD обычно прочно — но не ковалентно — связаны с соответствующим апоферментом. Многие флавопротеиновые ферменты содержат один или несколько ионов металлов, выполняющих роль кофакторов; такие флавопротеиновые ферменты называют металлофлавопротеинами.
К ферментам группы аэробных дегидрогеназ относится также дегидрогеназа L-аминокислот (оксидаза L-аминокислот) — находящийся в почках FMN-содержащий фермент с широкой специфичностью, катализирующий окислительное дезаминирование природных L-аминокислот. Широко распространена ксантиндегидрогеназа (ксантиноксидаза); она обнаружена в молоке, в тонком кишечнике, почках и печени. Ксантиндегидрогеназа содержит молибден; она играет важную роль в превращении пуриновых оснований в мочевую кислоту и особое значение имеет в печени и почках птиц, которые экскретируют мочевую кислоту как главный конечный азотсодержащий продукт метаболизма пуринов, а также катаболизма белков и аминокислот.

Рис. 12.6. Рибофлавинфосфат (флавинмононуклеотид, FMN).

Рис. 12.7. Флавинадениндинуклеотид (FAD).
Альдегиддегидрогеназа — FAD-содержащий фермент, находящийся в печени млекопитающих. Это — металлофлавопротеин, содержащий молибден и негемовое железо, окисляющий альдегиды и N-гетероциклические субстраты.
Глюкозооксидаза — FAD-специфичный фермент, получаемый из грибов. Она важна тем, что используется при определении глюкозы.
Механизм окисления и восстановления, осуществляемый этими ферментами, весьма сложен. Судя по имеющимся данным, происходит двустадийное восстановление изоаллоксазинового кольца с промежуточным образованием семихинона (свободного радикала) (рис. 12.8).
Анаэробные дегидрогеназы
А. Дегидрогеназы, зависимые от никотинамидных коферментов. В эту категорию попадает большое число дегидрогеназ. Они специфичны либо к никотинамидадениндинуклеотиду (NAD+), либо к никотинамидадениндинуклеотидфосфату (NADP+), выполняющим роль коферментов (рис. 12.9). Имеются, однако, дегидрогеназы, у которых коферментом может быть как NAD+, так и NADP+.
NAD+ и NADP+ образуются в организме человека из витамина ниацина. Ниацин включает никотиновую кислоту и ее амид (никотинамид) — каждое из этих соединений может, выполнять функции витамина в пищевом рационе. Для синтеза NAD+ или NADP+ ферменты, находящиеся в цитозоле большинства клеток, используют только никотиновую кислоту, но не никотинамид. Никотинамидный фрагмент NAD+ образуется из никотинатного фрагмента, когда последний находится в составе нуклеотида; амидная группа поступает из глутамина (рис. 12.9). Имеются данные о том, что в митохондриях для синтеза NAD+ используется никотинамид. Коферменты восстанавливаются специфическими субстратами дегидрогеназ и окисляются адекватным акцептором электронов (рис. 12.10). Коферменты могут свободно и обратимо диссоциировать из комплекса с соответствующими апоферментами.
В общем случае NAD-зависимые дегидрогеназы катализируют окислительно-восстановительные реакции окислительных путей метаболизма — гликолиза, цикла лимонной кислоты, дыхательной цепи митохондрий. NADP-завнснмые дегидрогеназы участвуют в процессах восстановительного синтеза, в частности во внемитохондриальном синтезе жирных кислот и стероидов; они также являются коферментами дегидрогеназ пентозофосфатного пути. Некоторые дегидрогеназы, функционирующие с никотинамидными коферментами, содержат ион цинка, в частности алкогольдегидрогеназа печени и глицеральдегид-3-фосфат-дегидрогеназа скелетных мышц. Полагают, что ионы цинка не участвуют непосредственно в процессах окисления и восстановления.

Рис. 12.8. Восстановление изоаллоксазинового кольца флавиновых нуклеотидов.

Рис. 12.9. Синтез и распад никотинамидадениндинуклеотида (NAD). Фосфорилирована 2'-гидроксильная группа (отмечено звездочкой) аденозинового фрагмента молекулы никотинамидадениндинуклеотидфосфата (NADP+). У человека в отличие, например, от кошки потребность в ниацине может быть обеспечена за счет триптофана при достаточном количестве его в диете. В норме за счет триптофана синтезируется примерно две трети имеющегося в организме ниацина. PRPP — 5-фосфорибозил-1 -пирофосфат.

Рис. 12.10. Механизм окисления и восстановления никотинамидных коферментов. Восстановление никотинамида субстратом (АН2) по положению 4 происходит стереоспецифически. Один из атомов водорода переносится от субстрата в положение 4 в виде ядра водорода с двумя электронами (гидрид-ион, Н-); он может присоединиться либо в А-, либо в В-положении в зависимости от специфичности дегидрогеназы, катализирующей данную реакцию. Другой водород, отщепляемый от субстрата, остается свободным в виде иона водорода.
Б. Рибофлавинзависимые дегидрогеназы. Флавиновые группы этих дегидрогеназ те же, что и у аэробных дегидрогеназ, FMN и FAD. Обычно они более прочно, чем никотинамидные коферменты, связаны с апоферментом. Большинство рибофлавин-зависимых анаэробных дегидрогеназ либо участвует в транспорте электронов по дыхательной цепи, либо поставляет электроны для этой цепи. NADH-дегидрогеназа — компонент дыхательной цепи, переносящий электроны от NADH к более электроположительным компонентам. Другие дегидрогеназы, например сукцинатдегидрогеназа, ацил-СоА-дегидрогеназа и митохондриальная глицерол-3-фосфат-дегидрогеназа, переносят восстановительные эквиваленты от субстрата непосредственно на дыхательную цепь. Еще одна функция флавин-зависимых дегидрогеназ — катализируемое дигидролипоилдегидрогеназой дегидрирование восстановленного липоата (интермедиата при окислительном декарбоксилировании пирувата и а-кетоглутарата) (см. рис. 18.5). В этом случае вследствие низкого значения окислительно-восстановительного потенциала системы липоата переносчиком водорода от восстановленного липоата к NAD+ является флавопротеин (FAD). Электронпереносящий флавопротеин является промежуточным переносчиком электронов между ацил-СоА-дегидрогеназой и дыхательной цепью (см. рис. 13.3).
В. Цитохромы. За исключением рассмотренной выше цитохромоксидазы, цитохромы классифицируются как анаэробные дегидрогеназы. Их идентификация и изучение облегчаются тем обстоятельством, что в восстановленном состоянии они имеют характерные полосы в спектре поглощения, которые исчезают при окислении. В дыхательной цепи они служат переносчиками электронов от флавопротеинов к цитохромоксидазе. Цитохромы являются железосодержащими гемопротеинами, у которых атом железа переходит из состояния Fe2+ в Fe3+ и обратно в процессе окисления и восстановления. В состав дыхательной цепи входят цитохромы b, с1, с, а и а3 (цитохромоксидаза). Из них растворимым является только цитохром с. Помимо дыхательной цепи цитохромы имеются в эндоплазматическом ретикулуме (цитохромы Р-450 и b5), в растительных клетках, бактериях и дрожжах.
Гидропероксидазы
А. Пероксидаза. Первоначально пероксидазы считались растительными ферментами, позднее они были обнаружены также в молоке, лейкоцитах, тромбоцитах, а также в тканях, в которых происходит метаболизм эйкозаноидов (см. с. 333). Простетической группой является протогем, который в отличие от гемовых групп большинства гемопротеинов весьма слабо связан с апоферментом. В реакции, катализируемой пероксидазой, перекись водорода восстанавливается за счет соединений, выступающих в качестве доноров электронов, таких, как аскорбат, хиноны или цитохром с. Реакция, катализируемая пероксидазой, имеет сложный характер; суммарная реакция выглядит следующим образом:
![]()
В эритроцитах глутатионпероксидаза, содержащая в качестве простетической группы селен, катализирует разложение Н2О2 и гидроперекисей липидов восстановленным глутатионом и таким образом защищает липиды мембран и гемоглобин от окисления перекисями.
Б. Каталаза. Это — гемопротеин, содержащий четыре гемовые группы. Наряду с пероксидазной активностью каталаза способна использовать одну молекулу Н2О2 в качестве донора электронов, а другую — как окислитель, т.е. акцептор электронов. In vivo в большинстве случаев каталаза разлагает пероксид водорода
![]()
Каталаза имеется в крови, костном мозге, мембранах слизистых оболочек, почках и печени. Ее функцией считается разложение перекиси водорода, образующейся при действии аэробных дегидрогеназ. Во многих тканях, включая и печень, обнаружены микротельца, пероксисомы, которые богаты аэробными дегидрогеназами и каталазой. По-видимому, биологически выгодно группировать в одном месте как ферменты, приводящие к образованию Н2О2, так и ферменты, разлагающие ее (рис. 12.11). К ферментам, обеспечивающим образование Н2О2, помимо пероксисомных ферментов относятся также митохондриальные и микросомные системы транспорта электронов.
Оксигеназы
Оксигеназы не относятся к ферментам, катализирующим реакции, снабжающие клетку энергией; они участвуют в синтезе и деградации многих типов метаболитов. Ферменты этой группы катализируют включение кислорода в молекулу субстрата. Оно происходит в две стадии: 1) кислород связывается с активным центром фермента; 2) происходит реакция, в результате которой связанный кислород восстанавливается или переносится на субстрат. Оксигеназы подразделяются на две подгруппы.
А. Диоксигеназы (кислород-трансферазы, истинные оксигеназы). Эти ферменты катализируют включение в молекулу субстрата обоих атомов молекулы

кислорода:
![]()
Примером служат железосодержащие ферменты гомогентизатдиоксигеназа и 3-гидроксиантранилат-диоксигеназа из супернатантной фракции гомогената печени, а также гемсодержащие ферменты, в частности L-триптофандиоксигеназа (триптофанпирролаза) из печени.
Б. Монооксигеназы (оксидазы со смешанной функцией, гидроксилазы). Эти ферменты катализируют включение в субстрат только одного из атомов молекулы кислорода. Другой атом кислорода восстанавливается до воды; для этой цели необходим дополнительный донор электронов (косубстрат):
![]()
Микросомные цитохром P-450-содержащие монооксигеназные системы
К этой группе относятся ферменты, участвующие в метаболизме многих лекарственных веществ путем их гидроксилирования. Они находятся в микросомах печени вместе С цитохромом Р-450 И цитохромом b5. Восстановителями этих цитохромов являются NADH и NADPH (рис. 12.12); цитохромы окисляются субстратами в результате серии ферментативных реакций, составляющих так называемый гидроксилазный цикл (рис. 12.13):

(Лек — лекарственное вещество).
К лекарственным веществам, метаболизм которых идет при участии рассматриваемых систем, относятся бензпирен, аминопирин, анилин, морфин и бензофетамин. Многие лекарственные вещества, например фенобарбитал, способны индуцировать синтез микросомных ферментов и цитохрома Р-450.
Митохондриальные цитохром P-450-содержащие монооксигеназные системы
Эти системы находятся в стероидогенных тканях — в коре надпочечников, в семенниках, яичниках и плаценте; они участвуют в биосинтезе стероидных гормонов из холестерола (гидроксилирование по С22 и С20 при отщеплении боковой цепи и по положениям 11ß и 18). Ферменты почечной системы катализируют гидроксилирование 25-гидроксихолекальциферола по положениям 1а и 24; в печени происходит гидроксилирование холестерола по положению 26 при биосинтезе желчных кислот. В коре надпочечников содержание митохондриального цитохрома Р-450 в шесть раз выше, чем содержание цитохромов дыхательной цепи. Монооксигеназная система состоит из трех компонентов, локализованных во внутренней митохондриальной мембране на границе с матриксом: NADP-специфичного FАD-содержащего флавопротеина, Fe2S2-бeлкa (адренодоксина) и цитохрома Р-450 (рис. 12.14).

Рис. 12.12. Цепь транспорта электронов в микросомах. Цианид (CN-) ингибирует стадию, указанную на рисунке.
Метаболизм супероксид-радикала
Кислород является потенциально токсичным веществом. До недавнего времени его токсичность связывали с образованием Н2О2. Однако в последнее время, принимая во внимание, во-первых, то обстоятельство, что кислород в тканях легко восстанавливается в супероксидный анион-радикал (O-2), и, во-вторых, наличие у аэробных организмов супероксиддисмутазы (ее нет у облигатных анаэробов), было выдвинуто предположение о том, что токсичность кислорода обусловлена его превращением в супероксид. Однако прямых данных о токсичности супероксид-радикала пока не получено.
Супероксид образуется в ходе одноэлектронного окисления молекулярным кислородом восстановленного флавина, например флавина в составе ксантиндегидрогеназы. Он образуется также при одноэлектронном окислении молекулярным кислородом восстановленного компонента дыхательной цепи:
![]()

Рис. 12.13. Цитохром P-450-гидроксилазный цикл в микросомах. Приведенная система типична для гидроксилаз стероидов в коре надпочечников. Микросомная цитохром P-450-гидроксилаза печени не нуждается в присутствии железосерного белка Fe2S2. Окись углерода (СО) ингибирует указанную на рисунке стадию.
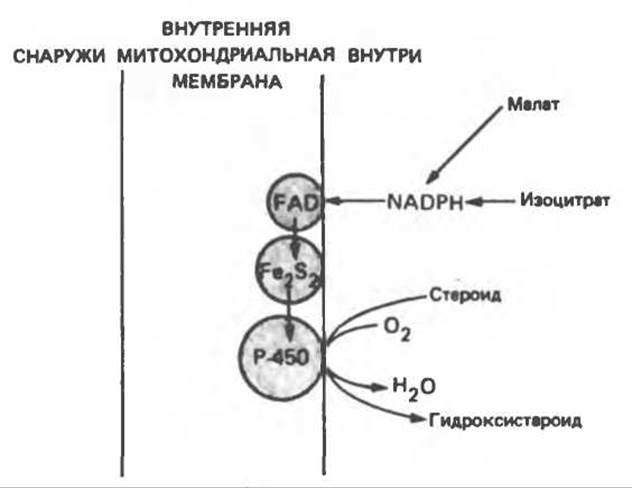
Рис. 12.14. Митохондриальная цитохром P-450-монооксигеназная система. Fe2S2 — железо-серный белок (адренодоксин). Поскольку NADP(H) не может проникать в митохондриальную мембрану, источниками восстановительных эквивалентов являются такие субстраты, как малат и изоцитрат, для которых внутри митохондрий имеются специфические NADP-зависимые дегидрогеназы.
Супероксид может восстанавливать окисленный цитохром c:
![]()
Он удаляется также специфическим ферментом — супероксиддисмутазой:

В этой реакции супероксид выступает одновременно как окислитель и как восстановитель. Химическое действие супероксида в тканях усиливается в результате инициирования цепной реакции образования свободных радикалов. Было высказано предположение, что О-2, связанный с цитохромом Р-450, является интермедиатом при активации кислорода в процессе реакций гидроксилирования (рис. 12.13).
Функцией супероксиддисмутазы является, по-видимому, защита аэробных организмов от повреждающего действия супероксида. Фермент обнаруживается в нескольких внутриклеточных компартментах. Цитозольный фермент состоит из двух сходных субъединиц, содержащих по одному иону Cu2+ и Zn2+; митохондриальный фермент, так же как и фермент, обнаруженный у бактерий, содержит ион Мn2+. Это обстоятельство служит еще одним свидетельством в пользу гипотезы о происхождении митохондрий из прокариот, вступивших в симбиоз с протоэукариотами. Дисмутаза присутствует во всех основных тканях аэробов. Пребывание животных в атмосфере 100%-ного кислорода вызывает адаптивное повышение содержания дисмутазы, особенно в легких; длительное пребывание в такой атмосфере приводит к повреждению легких и летальному исходу. Антиоксиданты, например а-токоферол (витамин Е), способны улавливать свободные радикалы, такие, как О-2, снижая тем самым токсичность кислорода.
Литература
Bonnett R. Oxygen activation and tetrapyrroles, Essays Biochem., 1981, 17, 1.
Ernster L. (ed.) Bioenergetics, Elsevier, 1984.
Fleisher S., Packer L. (ed.) Biological oxidations, microsomal, cytochrome P-450, and other hemoprotein systems. In: Methods in Enzymology, Vol. 52, Biomembranes, part C, Academic Press, 1978.
Friedovich I. Superoxide dismutases, Annu. Rev. Biochem., 1975, 44, 147.
Salemme F. R. Structure and function of cytochromes c, Annu. Rev. Biochem., 1977, 46, 299.
Schenk man J. B., Jansson I., Robie-Suh К. M. The many roles of cytochrome b5 in hepatic microsomes, Life Sci., 1976, 19, 611.
Tolbert N. E. Metabolic pathways in peroxisomes and glyoxysomes. Annu. Rev. Biochem., 1981, 50, 133.
Tyler D. D., Sutton С. M. Respiratory enzyme systems in mitochondrial membranes, Page 33. In: Membrane Structure and Function, Vol. 5, Bittar E. E. (ed.), Wiley, 1984. White R. E., Coon M. J. Oxygen activation by cytochrome P450, Annu. Rev. Biochem., 1980, 49, 315.