Основы биохимии - Филиппович Ю. Б. 1999
Гормоны и их роль в обмене веществ
Стероидные гормоны
Строение и функциональная активность стероидных гормонов. Как указано ранее, стероиды (см.гл. IX) представляют производные полициклических спиртов — стеролов, у которых укорочена (окислена) боковая цепь (20—27-й атомы). Из биологических объектов выделено несколько десятков стероидов, но только примерно двадцати из них свойственна гормональная функция. Так, в корковом слое надпочечных желез продуцируется более сорока различных стероидов, которым присвоено общее название — кортикостероиды. Восемь из них являются стероидными гормонами коры надпочечников. Наибольшее распространение и значение в организме имеют кортикостерон, 17-оксикортикостерон (гидрокортизон) и альдостерон (в сумме они составляют 4/5 всех кортикостероидов коры надпочечников):

В мужских и женских половых железах, а также в надпочечных железах синтезируется 10 стероидов, обладающих свойствами половых гормонов. Важнейшее значение из них имеют тестостерон (мужской половой гормон) и эстрадиол (женский половой гормон):

Кортикостерон — кристаллическое соединение с tпл = 182° С. Оптически активен ([a]D = +223°). В норме в надпочечниках человека в течение суток образуется 0,84—4,0 мг кортикостерона. При недостаточном поступлении кортикостерона в кровь, а следовательно, в ткани организма наступают нарушения в обмене углеводов, белков, липидов и минеральных элементов: сокращаются запасы гликогена в мышцах и печени, падает содержание глюкозы в крови, усиливается распад белков до аминокислот, растет содержание остаточного азота в крови, усиливаются липолитические процессы, нарушаются нормальная экскреция и обратное всасывание Na+ и К+ в канальцах почек, падает кровяное давление. Все это приводит к сердечной недостаточности, развитию отеков, мышечной слабости, развитию пигментации покровов (бронзовая болезнь) и другим патологическим явлениям. При избытке кортикостерона резко усиливаются анаболические процессы, что тоже приводит к ряду отклонений от нормы.
17-Оксикортикостерон (гидрокортизон или кортизол) — кристаллы с tпл = 220° С. Раствор его отклоняет плоскость поляризации света на значение [a]D = + 167°. В течение суток в надпочечниках синтезируется от 4,9 до 7,9 мг кортизола. В норме содержание кортизола в периферической крови человека составляет 11 мкг %. При его дефиците развиваются те же нарушения обмена веществ, что и при недостаточности кортикостерона, за исключением обмена минеральных элементов, на который кортизол оказывает незначительное влияние. Наиболее резко выражено при этом нарушение обмена углеводов, вследствие чего кортизол относят к разряду глюкокортикостероидов. Особенно характерны изменения в обмене веществ при избытке кортизола: резко усиливается превращение аминокислот в углеводы, возрастает синтез гликогена и жиров, повышается содержание глюкозы в крови (стероидный диабет). В результате развивается ожирение туловища, появляется «буйволиный» (жировые складки) затылок, лицо становится круглым и красным, тогда как мышцы атрофируются, скелет становится хрупким, а конечности — худыми.
Альдостерон — кристаллическое вещество с tпл = 219° С и оптической активностью растворов, характеризующейся [а]D = +88°. В надпочечниках за сутки образуется 0,15—0,4 мг альдостерони. На его долю приходится всего 1—2% от суммы кортикостероидов, тогда как кортикостерон и 17-оксикортикостерон содержится в ней в количестве 75%. В венозной крови человека альдостерон присутствует в концентрации 0,08 мкг %.
При недостаточности альдостерони развивается бронзовая болезнь. Однако особенно характерно при этом резкое нарушение минерального обмена— падение обратного всасывания Na+ в почечных канальцах и, как следствие этого, усиление задержки в организме К+. Поэтому альдостерон считают минералокортикостероидом. Его способность повышать обратное всасывание Na+ в канальцах почек в 300 раз выше, чем у кортизола, являющегося - глюкокортикостероидом. В то же время альдостерон не оказывает почти никакого влияния на обмен углеводов.
Тестостерон — кристаллы с tпл = 155° С. Оптически активен ( a)D = +117°). Синтезируется в семенниках, где его содержание у человека составляет 21,6 мкг % в сыром веществе. Он обусловливает нормальный рост мужских половых органов и развитие вторичных половых признаков у мужчин. При дефиците тестостерона у взрослых особей снижается биосинтез белков, развивается ожирение, утрачивается волосяной покров. Тестостерон, как и другие мужские половые гормоны, является типичным анаболическим стероидом, увеличивающим задержку азота в организме и усиливающим интенсивность новообразования белков.
Эстрадиол кристаллизуется в двух модификациях: в виде перистых листочков с tпл = 175—177° С и в форме призматических игл с tпл = 178,5—179,5° С. Вырабатывается в яичниках в количестве 1 мг в сутки. Вызывает течку и разрастание слизистой матки у животных. При недостаточности эстрадиола нарушаются циклы менструации, происходят самопроизвольные выкидыши, развивается ожирение. Эстрадиол оказывает влияние на обмен углеводов, белков и нуклеиновых кислот.
Механизм действия стероидных гормонов. Как видно из приведенных выше данных о функциональной активности рассмотренных стероидных гормонов, их влияние распространяется на многочисленные и разнообразные химические процессы в тканях организма. Следовательно, в отличие от ферментов или витаминов гормоны изменяют скорость протекания не какой-то конкретной химической реакции или группы сходных реакций, а затрагивают в обмене веществ некие фундаментальные процессы. Последние, в свою очередь, сказываются на самых различных сторонах обмена веществ. Указанный подход лежит в основе современных представлений о механизме действия гормонов.
Какие же фундаментальные процессы контролируются стероидными гормонами? По этому поводу в последние годы получены интересные сведения. Оказалось, что стероидные гормоны взаимодействуют с клетками-мишенями, мощно и избирательно регулируя в них синтез, в первую очередь, информационных РНК. Последние немедленно обеспечивают наработку специфических белков, оказывающих влияние на обмен веществ и как следствие этого на физиологические и иные процессы. Список этих белков, в том числе каталитически активных, сейчас достиг уже нескольких десятков.
Не следует думать, что стероидные гормоны непосредственно взаимодействуют с генетическим аппаратом клетки и прямо дерепрессируют ДНК. Регуляция при их посредстве биосинтеза мРНК идет более сложным путем: с хроматином вступает в контакт гормон-рецепторный комплекс. Он представляет собой комплекс стероидного гормона и белка-рецептора, образующийся в цитоплазме клетки-мишени, куда проникает соответствующий гормон и где всегда имеется специфичный к нему рецепторный белок (рис. 135). Более того, после присоединения стероидного гормона к белку-рецептору гормон часто преобразуется (например, восстанавливается по двойной связи в кольце А), а белок-рецептор изменяет свою конформацию. В последнее время появились данные о том, что рецепторный белок в норме постоянно соединен с веществом-модулятором его третичной структуры: присоединение стероидного гормона ведет к потере модулятора и изменению конформации гормон-рецепторного комплекса. Именно в новой конформации гормон-рецепторный комплекс транслоцируется в ядро, где связывается с акцепторным участком хроматина, переводя ДНК в этой зоне хроматина в транскрипционно-активное состояние.
Важно подчеркнуть, что лишь строго определенный стероидный гормон «узнает» свою клетку-мишень, а в ней — свой специфический белок-рецептор.
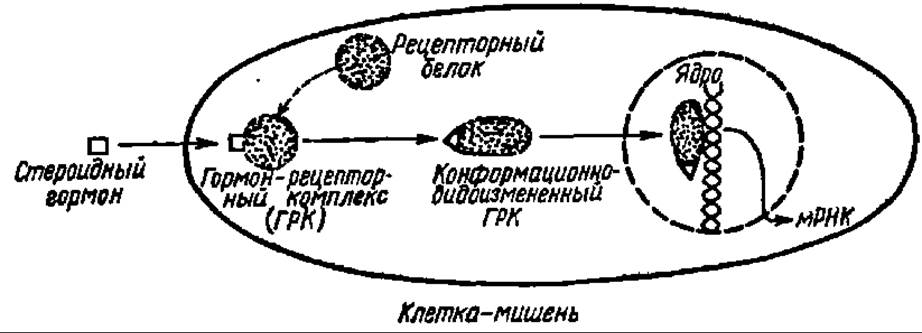
Рис. 135. Механизм действия стероидных гормонов (пояснения в тексте)
В свою очередь, возникший гормон-рецепторный комплекс сугубо избирательно атакует в ядре клетки ту область хроматина, которая содержит фрагмент ДНК, ответственный за синтез индивидуальной мРНК и, следовательно, белка с только ему присущей функциональной активностью. Так обеспечивается специфичность действия различных стероидных гормонов, в основе которой отчетливо вырисовывается ключевая роль цитоплазматических рецепторных белков, передающих гормональный сигнал генетическому аппарату клетки.
Белки-рецепторы интенсивно изучаются. Так, рецепторный белок для гидрокортизона имеет М = 67000, а для эстрадиола — М = 200 000. В последнем случае он состоит из двух субъединиц, одна из которых ответственна за связывание гормона, а вторая — акцепторного участка хроматина. В яйцеводах курицы, где сосредоточены клетки-мишени эстрадиола, ядра которых содержат до 500 мест акцептирования гормон-рецепторного комплекса каждое, в опытах по индукции биосинтеза яичного альбумина показано, что число молекул мРНК возрастает в несколько тысяч раз. В результате воздействия эстрадиола в яйцеводах резко повышается синтез яичного альбумина. Предполагают, что гормон-рецепторный комплекс фиксируется на ядерной ДНК при модулирующем действии лабильно связанных негистоновых белков хроматина, некоторые из которых, возможно, сами являются рецепторами стероидных гормонов.
Для других стероид-рецепторных комплексов зафиксировано от 8000 до 23 000 мест связывания на 1 пг ДНК и протяженность в 700—800 н. п., занимаемая гормон-рецепторным комплексом.
Было бы не совсем правильно сводить механизм действия стероидных гормонов к стимулированию биосинтеза только мРНК в тканях-мишенях, хотя это, конечно, центральное звено в регуляции обмена веществ при их посредстве. Накапливаются данные о том, что стероидные гормоны влияют на биосинтез ДНК, вызывая амплификацию генов и, как следствие этого, усиление биосинтеза других видов РНК (рРНК, гистоновых мРНК и т. п.). Появились также сведения о возможном трансмембранном механизме действия стероидных гормонов; так, например, экдизон (см. в конце этой главы) инициирует образование вторичных посредников из фосфоинозитидов (см. рис. 139 на с. 475).
Время полужизни молекул гормонов редко превышает 1 ч, поэтому для поддержания регуляции обмена веществ в организме на должном уровне их содержание должно поддерживаться путем непрерывного синтеза.
Биосинтез стероидных гормонов. Существует два пути биосинтеза стероидных гормонов. Сведения о том и другом получены методом меченых атомов. Первый путь состоит в превращении холестерола (схема 12) в стероидные гормоны путем окисления его в прогестерон и, далее, в другие производные последнего. Этот путь реализуется в надпочечных железах под влиянием адренокортикотропного гормона (см. ниже). Второй путь заключается в биосинтезе стероидных гормонов из ацетил-КоА, минуя холестерол. По всей вероятности, он осуществляется в соответствии с уравнением, приведенным в гл. IX при рассмотрении механизма новообразования холестерола. Однако в этом случае окисление боковой цепи (20—27-й атомы) наступает ранее образования холестерола.

Схема 12. Возможные пути биосинтеза стероидных гормонов
Как видно из схемы 12, при биосинтезе стероидных гормонов из того или иного предшественника центральное положение занимает прогестерон — уже в значительной степени окисленное производное, где при 3-м углеродном атоме кольца А сформирована кетогруппа, а между 4-м и 5-м углеродными атомами этого же цикла — двойная связь, тогда как боковая цепь при кольце D укорочена уже до двууглеродного фрагмента, также содержащего кетогруппу в положении 20.
Дальнейшее окисление СН3-группы боковой цепи при кольце D (20-й и 21-й углеродные атомы) приводит к возникновению 11-дезоксикортикостерона, который, в свою очередь, дает начало кортикостерону (дальнейшее окисление в кольце С по 11-му атому углерода) и альдостерону (окисление СН3-группы в 18-м положении).
Напротив, окисление прогестерона по кольцу D и образование ОН-группы в положении 17 приводит к 17-оксипрогестерону. Последний дает начало ряду стероидных гормонов: при полном окислении боковой цепи в кольце D возникает андростендион и, далее, эстрадиол и тестостерон, а при окислении углеродного атома, занимающего положение 11 (кольцо С), синтезируется 17- оксикортикостерон (см. схему 12).